Sktrofotometri merupakan suatu metoda analisa yang didasarkan pada pengukuran serapan sinar monokromatis oleh suatu lajur larutan berwarna pada panjang gelombamg spesifik dengan menggunakan monokromator prisma atau kisi difraksi dengan detektor fototube.
Spektrum Peresapan Inframerah suatu zat merupakan sifat fisika yang khas dan dapat digunakan sebagai pengenal. Daerah inframerah dalam spektrum radiasi elektromagnetik meliputi panjang gelombang antara 0,78 m, sesudai dengan 4000-1 cm sampai 667-1 cm, yaitu daerah yang paling banyak digunakan untuk identifikasi. Selain natrium klorida digunakan juga kisi-kisi sebagai monokromator.
Dasar spektrofotometri Infra Merah dikemukakan oleh Hooke dan didasarkan atas senyawa yang terdiri atas dua atom atau diatom yang digambarkan dengan dua buah bola yang saling terikat oleh pegas seperti tampak pada gambar disamping ini. Jika pegas direntangkan atau ditekan pada jarak keseimbangan tersebut maka energi potensial dari sistim tersebut akan naik.
Dari pembagian daerah spektrum elektromagnetik tersebut diatas, daerah panjang gelombang yang digunakan pada alat spektrofotometer infra merah adalah pada daerah infra merah pertengahan, yaitu pada panjang gelombang 2,5 – 50 µm atau pada bilangan gelombang 4.000 – 200 cm-1. Satuan yang sering digunakan dalam spektrofotometri infra merah adalah Bilangan Gelombang ( ) atau disebut juga sebagai Kaiser.
Bila ikatan bergetar, maka energi vibrasi secara terus menerus dan secara periodik berubah dari energi kinetik ke energi potensial dan sebaiknya. Jumlah energi total adalah sebanding dengan frekwensi vibrasi dan tetapan gaya ( k ) dari pegas dan massa ( m1 dan m2 ) dari dua atom yang terikat. Energi yang dimiliki oleh sinar infra merah hanya cukup kuat untuk mengadakan perubahan vibrasi.
Dalam spektrofotometri infra merah panjang gelombang dan bilangan gelombang adalah nilai yang digunakan untuk menunjukkan posisi dalam spektrum serapan. Panjang gelombang biasanya diukur dalam mikron atau mikro meter ( µm ). Sedangkan bilangan gelombang ( ) adalah frekwensi dibagi dengan kecepatan cahaya, yaitu kebalikan dari panjang gelombang dalam satuan cm-1.
Atom-atom di dalam suatu molekul tidak diam melainkan bervibrasi (bergetar). Energi dari kebanyakan vibrasi molekul berhubungan dengan daerah infra merah. Vibrasi molekul dapat dideteksi dan diukur pada spektrum infra merah. Bila radiasi infra merah dilewatkan melalui suatu cuplikan, maka molekul-molekulnya dapat menyerap (mengabsorbsi) energi dan terjadilah transisi diantara tingkat vibrasi dasar (ground state) dan tingkat vibrasi tereksitasi (excited state). Pengabsorbsian energi pada berbagai frekuensi dapat dideteksi oleh spektrometer infra merah, yang memplot jumlah radiasi infra merah yang diteruskan melalui cuplikan sebagai fungsi frekuensi (atau panjang gelombang) radiasi. Plot itu disebut spektrum infra merah yang akan memberikan informasi penting tentang gugus fungsional suatu molekul.
Maka di dalam makalah ini nanti akan dijelaskan lebih lanjut tentang pengertian infra merah, alat dan sistem kerja dan juga daerah-daerah sidik jari.
Spektrofotometer adalah alat untuk mengukur transmitan atau absorban suatu sampel sebagai fungsi panjang gelombang. Sedangkan pengukuran menggunakan spektrofotometer ini, metoda yang digunakan sering disebut dengan spektrofotometri.
Spektrofotometri dapat dianggap sebagai perluasan suatu pemeriksaan visual dengan studi yang lebih mendalam dari absorbsi energi. Absorbsi radiasi oleh suatu sample diukur pada berbagai panjang gelombangdan dialirkan oleh suatu perkam untuk menghasilkan spektrum tertentu yang khas untuk komponen yang berbeda.
Interaksi Sinar Infra Merah Dengan Molekul
Dasar Spektroskopi Infra Merah dikemukakan oleh Hooke dan didasarkan atas senyawa yang terdiri atas dua atom atau diatom yang digambarkan dengan dua buah bola yang saling terikat oleh pegas seperti tampak pada gambar disamping ini. Jika pegas direntangkan atau ditekan pada jarak keseimbangan tersebut maka energi potensial dari sistim tersebut akan naik.
Setiap senyawa pada keadaan tertentu telah mempunyai tiga macam gerak, yaitu:
1. Gerak Translasi, yaitu perpindahan dari satu titik ke titik lain.
2. Gerak Rotasi, yaitu berputar pada porosnya, dan
3. Gerak Vibrasi, yaitu bergetar pada tempatnya.
Bila ikatan bergetar, maka energi vibrasi secara terus menerus dan secara periodik berubah dari energi kinetik ke energi potensial dan sebaiknya. Jumlah energi total adalah sebanding dengan frekwensi vibrasi dan tetapan gaya ( k ) dari pegas dan massa ( m1 dan m2 ) dari dua atom yang terikat. Energi yang dimiliki oleh sinar infra merah hanya cukup kuat untuk mengadakan perubahan vibrasi.
Perubahan Energi Vibrasi
Atom-atom di dalam molekul tidak dalam keadaan diam, tetapi biasanya terjadi peristiwa vibrasi. Hal ini bergantung pada atom-atom dan kekuatan ikatan yang menghubungkannya. Vibrasi molekul sangat khas untuk suatu molekul tertentu dan biasanya disebut vibrasi finger print. Vibrasi molekul dapat digolongkan atas dua golongan besar, yaitu :
1. Vibrasi Regangan (Streching)
2. Vibrasi Bengkokan (Bending)
1. Vibrasi Regangan (Streching)
Dalam vibrasi ini atom bergerak terus sepanjang ikatan yang menghubungkannya sehingga akan terjadi perubahan jarak antara keduanya, walaupun sudut ikatan tidak berubah. Vibrasi regangan ada dua macam, yaitu:
Regangan Simetri, unit struktur bergerak bersamaan dan searah dalam satu bidang datar.
Regangan Asimetri, unit struktur bergerak bersamaan dan tidak searah tetapi masih dalam satu bidang datar.
2. Vibrasi Bengkokan (Bending)
Jika sistim tiga atom merupakan bagian dari sebuah molekul yang lebih besar, maka dapat menimbulkan vibrasi bengkokan atau vibrasi deformasi yang mempengaruhi osilasi atom atau molekul secara keseluruhan.
Vibrasi bengkokan ini terbagi menjadi empat jenis, yaitu :
a. Vibrasi Goyangan (Rocking), unit struktur bergerak mengayun asimetri tetapi masih dalam bidang datar.
b. Vibrasi Guntingan (Scissoring), unit struktur bergerak mengayun simetri dan masih dalam bidang datar.
c. Vibrasi Kibasan (Wagging), unit struktur bergerak mengibas keluar dari bidang datar.
d. Vibrasi Pelintiran (Twisting), unit struktur berputar mengelilingi ikatan yang menghubungkan dengan molekul induk dan berada di dalam bidang datar.
e. Spektrum Infra Merah memetakan ribuan spektrum infra merah dan menentukan panjang gelombang absorbsi masing-masing gugus fungsi. Vibrasi suatu gugus fungsi spesifik pada bilangan gelombang tertentu. Dari Tabel 2 diketahui bahwa vibrasi bengkokan C–H dari metilena dalam cincin siklo pentana berada pada daerah bilangan gelombang 1455 cm-1. Artinya jika suatu senyawa spektrum senyawa X menunjukkan pita absorbsi pada bilangan gelombang tersebut tersebut maka dapat disimpulkan bahwa senyawa X tersebut mengandung gugus siklo pentana.
f. Tabel. Serapan Khas Beberapa Gugus fungsi
Gugus | Jenis Senyawa | Daerah Serapan (cm-1) |
C-H | 2850-2960, 1350-1470 | |
C-H | 3020-3080, 675-870 | |
C-H | 3000-3100, 675-870 | |
C-H | 3300 | |
C=C | Alkena | 1640-1680 |
C=C | aromatik (cincin) | 1500-1600 |
C-O | 1080-1300 | |
C=O | 1690-1760 | |
C-H | 3300 | |
O-H | alkohol, fenol(monomer) | 3610-3640 |
O-H | alkohol, fenol (ikatan H) | 2000-3600 (lebar) |
O-H | asam karboksilat | 3000-3600 (lebar) |
N-H | 3310-3500 |
Daerah jangkauan spektrum
Filter fotometr hanya dapat digunakan untuk mengukur serapan sinar tampak (400-750 nm). Sedangkan spektrofotometer dapat mengukur serapan di daerah tampak, UV (200-380 nm) maupun IR (> 750 nm).
Sumber sinar
Sesuai dengan daerah jangkauan spektrumnya maka spektrofotometer menggunakan sumber sinar yang berbeda pada masing-masing daerah (sinar tampak, UV, IR). Sedangkan sumber sinar filter fotometer hanya untuk daerah tampak.
Monokromator
Filter fotometere menggunakan filter sebagai monokrmator. Tetapi pada spektro digunakan kisi atau prisma yang daya resolusinya lebih baik.
Detektor
- Filter fotometer menggunakan detektor fotosel
- Spektrofotometer menggunakan tabung penggandaan foton atau fototube.
Komponen utama dari spektrofotometer yaitu :
1. Sumber cahaya
Untuk radisi kontinue :
- Untuk daerah UV dan daerah tampak :
- Lampu wolfram (lampu pijar) menghasilkan spektrum kontiniu pada gelombang 320-2500 nm.
- Lampu hidrogen atau deutrium (160-375 nm)
- Lampu gas xenon (250-600 nm)
Untuk daerah IR
Ada tiga macam sumber sinar yang dapat digunakan :
- Lampu Nerst,dibuat dari campuran zirkonium oxida (38%) Itrium oxida (38%) dan erbiumoxida (3%)
- Lampu globar dibuat dari silisium Carbida (SiC).
- Lampu Nkrom terdiri dari pita nikel krom dengan panjang gelombang 0,4 – 20 nm
- Spektrum radiasi garis UV atau tampak :
- Lampu uap (lampu Natrium, Lampu Raksa)
- Lampu katoda cekung/lampu katoda berongga
- Lampu pembawa muatan dan elektroda (elektrodeless dhischarge lamp)
- Laser
2. Pengatur Intensitas
Berfungsi untuk mengatur intensitas sinar yang dihasilkan oleh sumber cahaya agar sinar yang masuk tetap konstan.
3. Monokromator
Berfungsi untuk merubah sinar polikromatis menjadi sinar monokromatis sesuai yang dibutuhkan oleh pengukuran
Macam-macam monokromator :
- Prisma
- kaca untuk daerah sinar tampak
- kuarsa untuk daerah UV
- Rock salt (kristal garam) untuk daerah IR
- Kisi difraksi
Keuntungan menggunakan kisi :
- Dispersi sinar merata
- Dispersi lebih baik dengan ukuran pendispersi yang sama
- Dapat digunakan dalam seluruh jangkauan spektrum
4. Kuvet
Pada pengukuran di daerah sinar tampak digunakan kuvet kaca dan daerah UV digunakan kuvet kuarsa serta kristal garam untuk daerah IR.
5. Detektor
Fungsinya untuk merubah sinar menjadi energi listrik yang sebanding dengan besaran yang dapat diukur.
Syarat-syarat ideal sebuah detektor :
- Kepekan yang tinggi
- Perbandingan isyarat atau signal dengan bising tinggi
- Respon konstan pada berbagai panjang gelombang.
- Waktu respon cepat dan signal minimum tanpa radiasi.
- Signal listrik yang dihasilkan harus sebanding dengan tenaga radiasi.
Macam-macam detektor :
- Detektor foto (Photo detector)
- Photocell
- Phototube
- Hantaran foto
- Dioda foto
- Detektor panas
6. Penguat (amplifier)
Berfungsi untuk memperbesar arus yang dihasilkan oleh detektor agar dapat dibaca oleh indikator.
7. Indikator
Dapat berupa :
- Recorder
- Komputer
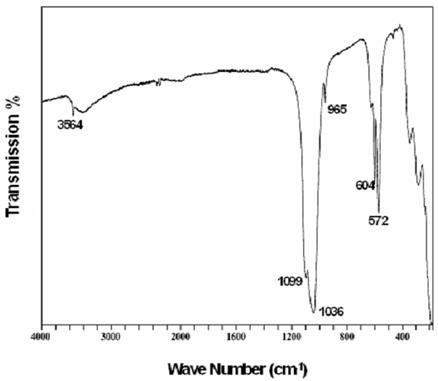
Spektrum Infra-merah sebuah asam karbon sederhana.
Asam etanoat
Asam etanoat mempunyai struktur sebagai berikut:
Dari struktur diatas dapat diketahui bahwa senyawa tersebut terdiri dari ikatan-ikatan sebagai berikut:
-Ikatan rangkap karbon-oksigen, C=O
-Ikatan tunggal karbon-oksigen, C-O
-Ikatan oksigen-hidrogen, O-H
-Ikatan karbon-hidrogen, C-H
om: .0001pt; margin: 0cm; text-align: justify;">
-Ikatan tunggal carbon-carbon, C-C
Ikatan karbon-karbon mempunyai penyerapan cahaya yang terjadi pada gelombang dalam jangkauan yang luas didalam ‘Area sidik jari’ sehingga sangat sulit untuk membedakan spek
trum infra-merahnya.
trum infra-merahnya.
Ikatan tunggal karbon-oksigen juga mempunyai penyerapan dalam ‘Area sidik jari’, yang berkisar antara 1000 – 1300cm-1,tergantung pada molekul yang mempunyai ikatan tersebut. Anda harus sangat hati-hati dalam membedakan mana yang merupakan spektrum ikatan C-O. Ikatan-ikatan lainnya dalam asam etanoat ini dapat diketahui secara mudah dengan memperhatikan penyerapan di luar area sidik jari.
Ikatan C-H (dimana hidrogen tersebut menempel pada karbon yang mempunyai ikatan tunggal dengan unsur-unsur lainnya) menyerap sinar pada jangkauan sekitar 2853-2962 cm-1. Karena ikatan ini terdapat pada sebagian besar senyawa ornganik, maka ini sangatlah tidak bisa diandalkan. Maksud saya adalah anda bisa mengabaikan lembah pada sekitar sedikit di bawah 3000 cm-1, karena mungkin itu hanya karena ikatan C-H saja.Ikatan rangkap antara karbon-oksigen, C=O, adalah salah satu penyerapan yang sangat berguna, yang bisa anda temukan pada daerah sekitar 1680-1750 cm-1. Posisinya sedikit terpengaruh oleh jenis senyawa yang mempunyai ikatan tersebut.
Ikatan lainnya yang sangat berguna adalah ikatan O-H. Ikatan ini menyerap sinar yang berbeda-beda, tergantung pada kondisi lingkungannya. Ikatan ini akan sangat mudah dikenali dalam sebuah asam karena akan menghasilkan lembah yang sangat luas pada daerah sekitar 2500-3300 cm-1.
DATA PANGAMATAN
Spektrum infra-merah untuk asam etanoat adalah sebagai berikut:
Kemungkinan penyerapan yang disebabkan oleh ikatan tunggal C-O ini diragukan karena terletak pada area sidik jari. Anda tidak bisa yakin bahwa lembah ini terbentuk bukan karena ikatan yang lain.
Catatan: spektrum Infra-merah pada halaman ini dibuat berdasarkan data yang diambil dari Spectral Data Base for Organic Compounds (SDBS) di National Institute of Materials and Chemical Research di Jepang.
Ada kemungkinan bahwa kesalahan-kesalahan kecil mungkin timbul dalam proses perubahan dari data tersebut untuk digunakan dalam situs ini, tapi itu tidak akan mempengaruhi argument ini sedikitpun.
Etanol
Ikatan O-H yang terdapat pada alkohol menyerap sinar dengan bilangan gelombang yang lebih besar daripada ikatan O-H yang terdapat dalam asam, yaitu sekitar 3230-3550 cm-1. Dan lagi penyerapan ini akan terjadi pada bilangan gelombang yang lebih besar lagi jika alkohol ini tidak terikat dengan ikatan hidrogen, seperti alkohol dalam bentuk gas. Semua spektrum infra-merah pada halaman ini dilakukan dalam bentuk cairan sehingga kemungkinan itu tidak akan muncul.
Perhatikan bahwa penyerapan karena ikatan C-H hanya sedikit dibawah 3000cm-1,dan juga pada lembah-lembah sekitar 1000-1100cm-11, dimana salah satunya disebabkan oleh ikatan C-O
Etil Etanoat
Pada grafik ini penyerapan oleh O-H hilang sama sekali. Jangan bingung dengan lembah yang disebabkan oleh C-H yang sebagian kecil berada pada sekitar 3000cm-1. Keberadaan ikatan rangkap C=O dapat dilihat sekitar 1740cm-1.
Ikatan tunggal C-O menyebabkan penyerapan pada sekitar 1240cm-1. Pertanyaan apakah anda bisa menentukan lembah tersebut adalah tergantung pada tabel data atau detail yang diberikan pada anda waktu ujian, karena ikatan tunggal C-O itu tersebar pada daerah 1000-1300cm-1, tergantung pada jenis senyawa apa yang mempunyai ikatan ini. Beberapa tabel data ada yang memutuskan bahwa penyerapan dari 1230-1250 adalah karena ikatan C-O pada sebuah etanoat.
Propanon
Anda akan berpikir bahwa grafik ini sangat mirip dengan spektrum infra-merah etil etanolat dan ester. Karena tidak ada lembah yang disebabkan oleh ikatan O-H, dan karena adanya penyerapan tegas yang disebabkan oleh ikatan C=O pada daerah sekitar 1700cm-
Hal yang juga membingungkan, terdapat juga penyerapan yang kelihatannya merupakan penyerapan karena ikatan tunggal C-O, yang tentunya tidak ada pada propanon. Hal ini menyebabkan harus mencoba mengidentifikasi penyerapan-penyerapan yang ada pada daerah sidik jari. Golongan aldehid akan mempunyai spektrum infra-merah yang sama dengan golongan keton.
Spektrum infra-merah golongan asam hidroksil
Asam 2-hidroksipropanoat (asam laktat)
Grafik ini sangat menarik, karena mempunyai dua macam ikatan O-H dimana yang satu terikat pada asam dan yang satunya lagi merupakan ‘alkohol’ yang terikat pada rantai golongan -COOH.
Ikatan O-H dalam golongan asam timbul pada daerah sekitar 2500-3300, sedangkan yang terikat pada rantai pada daerah sekitar 3230-3550cm-1. Bila digabungkan, akan menjadi lembah dengan jangkauan yang sangat besar meliputi daerah 2500-3550cm-1. Binggung pada daerah lembah tersebut akan sama seperti penyerapan yang disebabkan oleh ikatan C-H.
Perhatikan juga bahwa keberadaan ikatan C=O yang kuat pada daerah sekitar 1730cm-1.
Spektrum infra-merah amine primer
Amine primer ini mempunyai group -NH2 yang juga termasuk ikatan N-H. Penyerapan group ini timbul pada daerah sekitar 3100-3500cm-1.Dua lembah tersebut (ciri khas amine primer) bisa dilihat secara jelas pada spektrum sebelah kiri dari penyerapan oleh C-H.
BAB III
GAMBAR RANGKAIAN
3.1. Gambar Peralatan
1.1 Tujuan Percobaan Praktikum :
Untuk mengetahui dan dapat melakukan suatu analisa senyawa dengan menggunakan sprektrofotometer infra merah sehingga diketahui gugus gugus fungsionil dari senyawa tersebut.
1.2 Prinsip Kerja Praktikum :
Sprektrofotometer infra merah dapat digunakan untuk mempelajari sifat sifat bahan , dimana struktur zat yang diuji dapat diamati pada sprektrogram panjang gelombang vs transmittasi yang sangat spesifik dan merupakan sidik jari suatu molekul. Sprektogram zat yang diuji dibandingkan dengan sprektogram dari bahan yang sudah diketahui sprektra nya.
PROSEDUR KERJA
2.1 Alat dan Bahan
Alat yang digunakan dalam praktikum ini adalah :
1. Pena / pencatat recorder
2. kertas recorder
3. Sprektrofotometer infra merah
2.2 Bahan yang digunakan
Bahan yang dipergunakan adalah :
1. sampel / kalibrasi
2. larutan Kalium bromida
3. Pelarut lainnya seperti Chloroform / Asetan.
2.3 Prosedur Kerja
Standarisasi alat / kalibrasi alat :
Hidupkan power selama 15 menit.
1. Atur posisi pena / pencatat recorder pada posisi 4000 nm
2. Panjang gelombang ditempatkan pada posisi 4000 nm
3. Tempatkan sampel / kalibrasi pada tempatnya
4. Kecepatan kertas 12 menit setiap pekerjaan
5. Tekan tombol pena posisi 4000 nm
6. Tekan scanning
Cara Menyiapkan Bahan
Cara cara penanganan cuplikan tergantung dari jenis cuplikan yaitu apakah berbentuk gas, cairan atau padatan. Cara yang paling mudah dalam menangani cuplikan dalam bentuk cairan adalah menempatkan cuplikan tersebut sebagai film yang tipis diantara 2 lapisan KBr yang transparan terhadap infrared.
Karena digunakan KBr maka setelah selesai harus segera dibersihkan dengan mencuci denan pelarut pelarut seperti Chloroform, Asetan dan sebagainya. KBr harus dijaga tetap bersih / kering dan harus dipegang pada ujungnya.







thaks on your information
BalasHapus